För att minska korrosionen av metaller kan olika metoder användas:
- Elektrolytisk ytbehandling, elektroplätering (förzinkning, zink-nickel elektroplätering etc.)
- Ett val av lämpliga material
- En design av produkten
- Korrekt installation och underhåll
Korrosionsprocess
Kemisk och elektrokemisk korrosion.
Kemisk korrosion kan beaktas som oxidation och uppstår genom verkan av torra gaser, ofta vid höga temperaturer. Elektrokemisk korrosion sker å andra sidan genom elektrodreaktioner, ofta i fuktiga miljöer, dvs våtkorrosion. Alla metaller i torr luft är täckta av ett mycket tunt lager av oxid, ca 100Å (10-20nm) tjockt. Detta skikt är uppbyggt av kemisk reaktion med syret i luften. Vid mycket höga temperaturer kan reaktionen med syret i luften fortsätta utan återhållsamhet och metallen kommer snabbt att transformeras till en oxid.
Korrosionen av stål kan betraktas som en elektrokemisk process som sker i flera steg. Initiala attacken inträffar vid anodiska platser på ytan där järnjoner går i lösning. Elektroner släpps från anoden och rör sig genom metallstrukturen till de intilliggande katodiska sidorna på ytan, där de kombinerar med syre och vatten för att bilda hydroxyljoner. Vidare reagerar hydroxyljoner med järn jonerna från anoden och bildar järnhydroxid, vilken i sig oxideras ytterligare i luft för att producera hydrerad järnoxid (dvs röd rost). Summan av dessa reaktioner kan representeras av följande ekvation:
Våthetstid är andelen av den totala tiden under vilken ytan är våt på grund av regn eller kondensation. Det följer att för oskyddat stål i torra miljöer, t.ex. inomhus, kommer korrosion att vara minimal på grund av låg tillgänglighet av vatten.
Drivkraften för strömflödet och därigenom korrosionen är skillnaden i elektrodpotentialen. Elektrodpotentialen hos en metall är en indikation på metallens tendens att upplösa och korrodera i en viss elektrolyt. Ju ädlare metallen desto högre är potentialen desto mindre tenderar den att lösas i en elektrolyt.
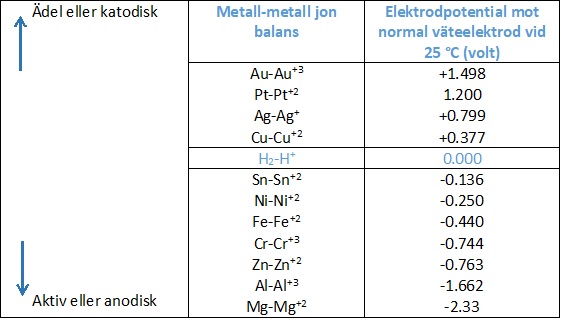
Med hänsyn till järn-koppar exemplet kommer det att noteras från tabellen ovan att koppar har en högre potential (är ädelare) än järn. Järnet kommer att vara anoden och korrodera, medan kopparet kommer att vara katoden och inte korrodera.
Olika typer av korrosion
Allmän korrosion
Allmänna korrosioner kännetecknas av en övergripande attack på ytan. Korrosionen sker utan särskiljande anodiska och katodiska områden.
Lokal korrosion
Lokal korrosion är motsatsen till allmän korrosion. Vid lokal korrosion är det mesta av metallytan opåverkad och endast små områden påverkas starkt. Det är mycket lättare att kompensera för jämn korrosion och att vidta förebyggande åtgärder i konstruktionen än att ta hänsyn till lokala korrosionsattacker.
Bimetallkorrosion
- Storleksförhållandet mellan katoden och anoden (ett större anodområde jämfört med ett katodområde reducerar de galvaniska effekterna)
- Storleken på elektrodpotentiella skillnad
- Ledningsförmågan hos elektrolyten (vätskan)
Gropfrätning
Korngränsfrätning
Intergranulär korrosion uppstår mellan korngränserna inuti en metall. Korngränserna fungerar som anoder medan kornen fungerar som katodytor. Denna typ av korrosion är välkänd för rostfria stål som är exponerad under en lång tidsperiod vid temperaturer mellan 500 och 800 ° C. Vid denna temperatur kommer krom att reagera med kol vid korngränserna och bilda karbider. Detta orsakar en brist av krom i närhet av korngränserna. Om kromhalten faller under 12% kan korrosion lätt starta.
Spänningskorrosion
Erosionskorrosion. Erosionskorrosion är en kombination av elektrokemisk korrosion (dvs generell korrosion) och av en turbulent strömning av vätskor. Angrepp är i allmänhet lokaliserade till områden med turbulent flöde och främjas av gasbubblor och fasta partiklar.
Filiform korrosion
Filiform korrosion uppstår under målade eller pläterade ytor när fukt genomtränger beläggningen. Det är en typ av lokaliserad korrosion som är ofta förknippade med aluminium- och magnesiumlegeringar som har en organisk beläggning. Lackerad yta och snabbtorkande färger på en yta är mest mottagliga för problemet. Filiform korrosion tenderar att uppstå vid hög luftfuktighet, t.ex. större än 75% och temperaturer över rumstemperaturen.

